Sci Adv | 上海药物所合作鉴定中东呼吸综合征冠状病毒离子通道
2025年7月9日,中国科学院上海药物研究所高召兵研究员和夏冰清研究员团队联合美国麻省理工学院Mei Hong教授团队在Science Advances期刊发表题为“Ion channel structure and function of the MERS coronavirus E protein”的研究论文。该研究揭示了MERS-E蛋白作为离子通道的结构基础和功能属性,为靶向病毒离子通道的抗冠状病毒药物研发提供了一定的理论指导。
病毒离子通道是一类广泛存在于病毒的膜蛋白。病毒侵入宿主细胞后,病毒离子通道能够定位于宿主的质膜、内质网、高尔基体等生物膜上,具有增强膜通透性、调节膜内外离子稳态、改变细胞器pH值等功能。一方面,病毒离子通道通过其通道功能调节自身或宿主细胞的生理环境,为病毒自身繁殖提供有利条件;另一方面,病毒离子通道可作为一种毒力因子,影响宿主细胞的生理功能,是病毒致病进程的重要因素。冠状病毒的包膜蛋白(Envelope protein,E)能够形成离子通道,参与病毒的生命进程及宿主细胞的致病进程,多项研究显示其为一类潜在的抗冠状病毒药物靶点。
严重急性呼吸综合征冠状病毒(SARS-CoV-1)、中东呼吸综合征冠状病毒(MERS-CoV)和新型冠状病毒(SARS-CoV-2)是三种高致病性的冠状病毒,自2002年以来引发了三次全球性大流行。其中,SARS-CoV和SARS-CoV-2的E蛋白已被证实为阳离子通道,能够通透钾、钠、钙、镁等多种阳离子。这两种E蛋白在中性pH下易形成紧密的五螺旋束,构成不透水的孔道,而在酸性和钙离子条件下,E蛋白跨膜域中间的三个苯丙氨酸残基会旋转到脂质一侧,从而打开离子通道。然而,MERS-E蛋白的结构特征与通道属性尚不清晰。
在本研究中,科研人员结合核磁共振(NMR)、单通道电生理及单点突变等技术,解析了MERS-E蛋白的通道结构,揭示了相关功能属性。首先,研究人员纯化了全长的MERS-E蛋白,并通过单通道电生理检测技术证实了其阳离子通透性。通道属性分析揭示了MERS-E通道电导与SARS1/2-E存在显著区别。进一步的NMR结构解析显示,MERS-E的五聚体结构展示了一个由疏水与极性残基共同稳定、具有两个孔道收缩部位的阳离子通道,其构象和功能调控机制与SARS1/2-E存在明显差异。MERS-E跨膜区的高分辨结构表明,其N端的极性-芳香网络(N15A、F13V)以及C端的芳香网络(F33V)可能对通道调控起关键作用。针对这两部分调控网络的单点突变会显著降低MERS-E的通道活性,进一步验证了这些位点的重要作用。
本研究揭示了MERS-E跨膜区芳香网络协同介导阳离子通透的作用机制。该机制提示,靶向这些芳香烃残基及保守的极性氨基酸残基开发小分子药物,可能有效抑制该致病通道的功能。MERS-E与SARS1/2-E在结构和功能上的比较表明,虽然两者在整体折叠上相似,但在孔道特性与导通机制方面已演化出不同策略,反映出病毒通过不同方式破坏宿主离子稳态以增强毒力的能力。综上所述,本研究解析了MERS-E蛋白的通道属性及结构基础,为靶向MERS-E通道的抗病毒药物研发提供理论指导。
美国麻省理工学院Mei Hong教授和上海药物所高召兵研究员为论文的共同通讯作者,美国麻省理工学院Iva Sucec博士和上海药物所夏冰清研究员为论文的共同第一作者。共同作者还包括Noah H. Somberg、王翼、Hyunil JO、李双渠和Barbara Perrone。此项研究得到美国国立卫生研究院(U19AI171110)、美国国家科学基金会(1745302)、中国国家自然科学基金(82341058)等项目的资助。
原文链接:https://www.science.org/doi/10.1126/sciadv.adx1788
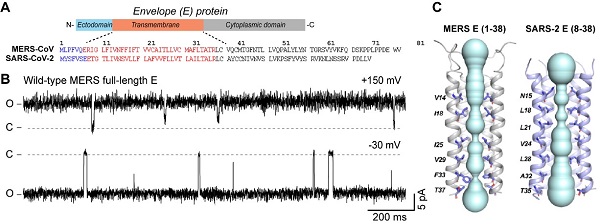
图1. MERS-E 蛋白形成病毒离子通道
(供稿部门:高召兵课题组)