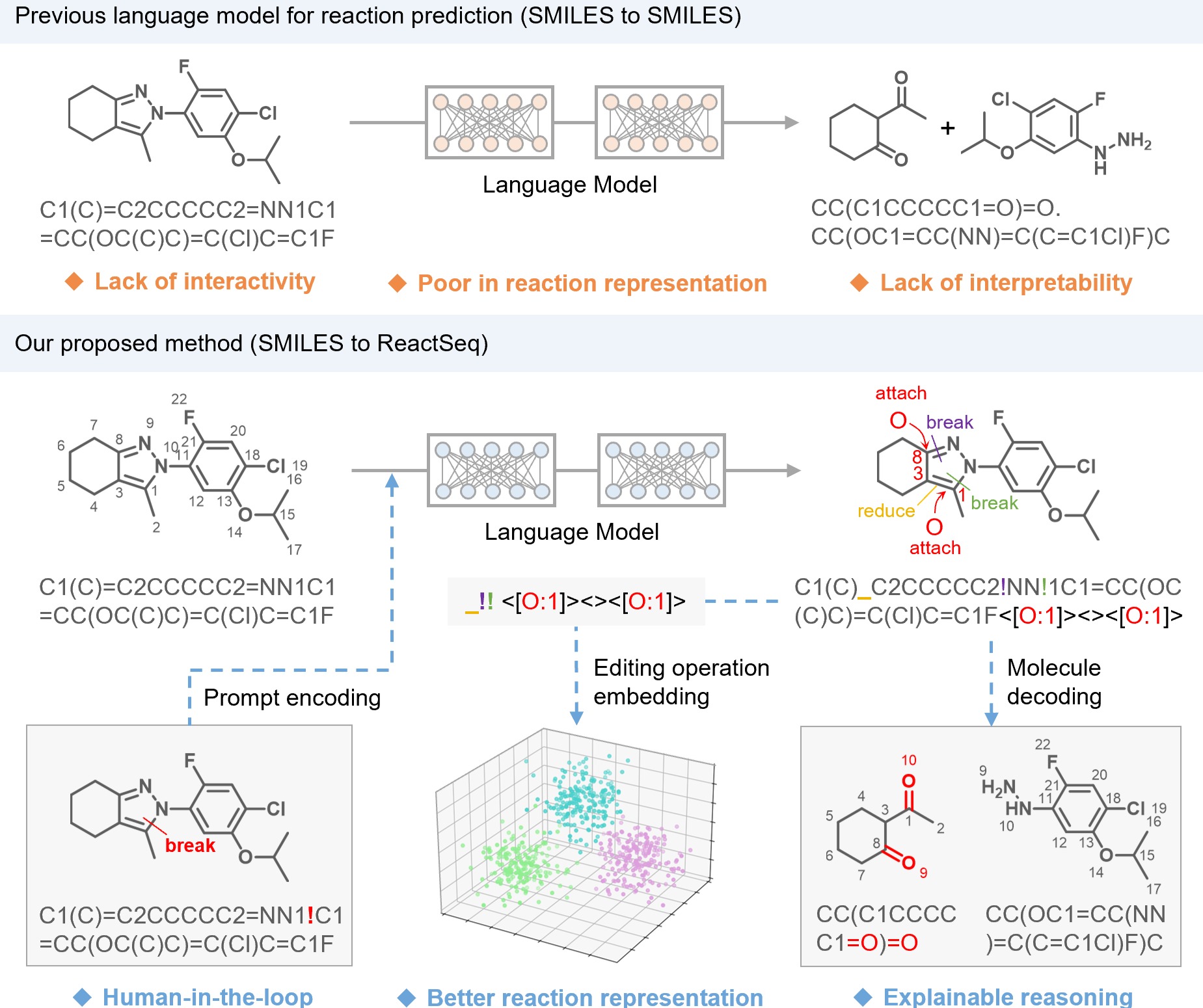
PNAS | 上海药物所揭示前列腺素PGE2激活其受体EP1的关键机制
2025年5月14日,中国科学院上海药物研究所徐华强与徐有伟研究团队,结合分子生物学和冷冻电镜技术,成功解析了人源前列腺素E2(Prostaglandin E2, PGE2)与其受体EP1及异源三聚体Gq蛋白复合物的高分辨率结构,揭示了PGE2识别并激活EP1受体的分子机制。相关研究成果以“Structural insights into the activation of the human prostaglandin E2 receptor EP1 subtype by prostaglandin E2”为题发表于《美国国家科学院院刊》(PNAS)。
前列腺素E2是一种源自花生四烯酸代谢的内源性脂质分子,参与炎症反应、血管舒张、痛觉感知等多种生理过程。其通过结合EP1-EP4四种亚型的G蛋白偶联受体(GPCRs)发挥功能。尽管EP2、EP3和EP4与PGE2及G蛋白的复合物结构已相继被解析,EP1受体由于其结构不稳定性,始终未能获得高分辨率结构,严重制约了对其信号机制的深入理解。
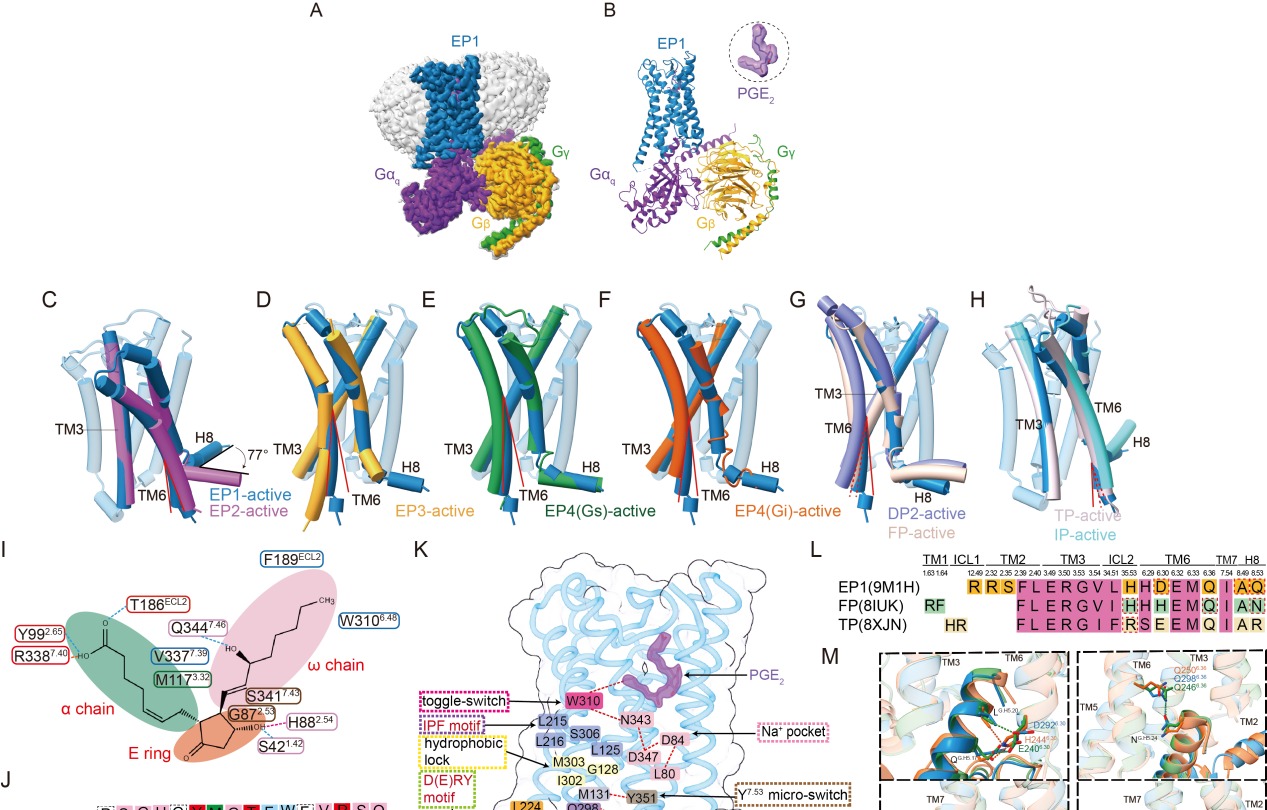
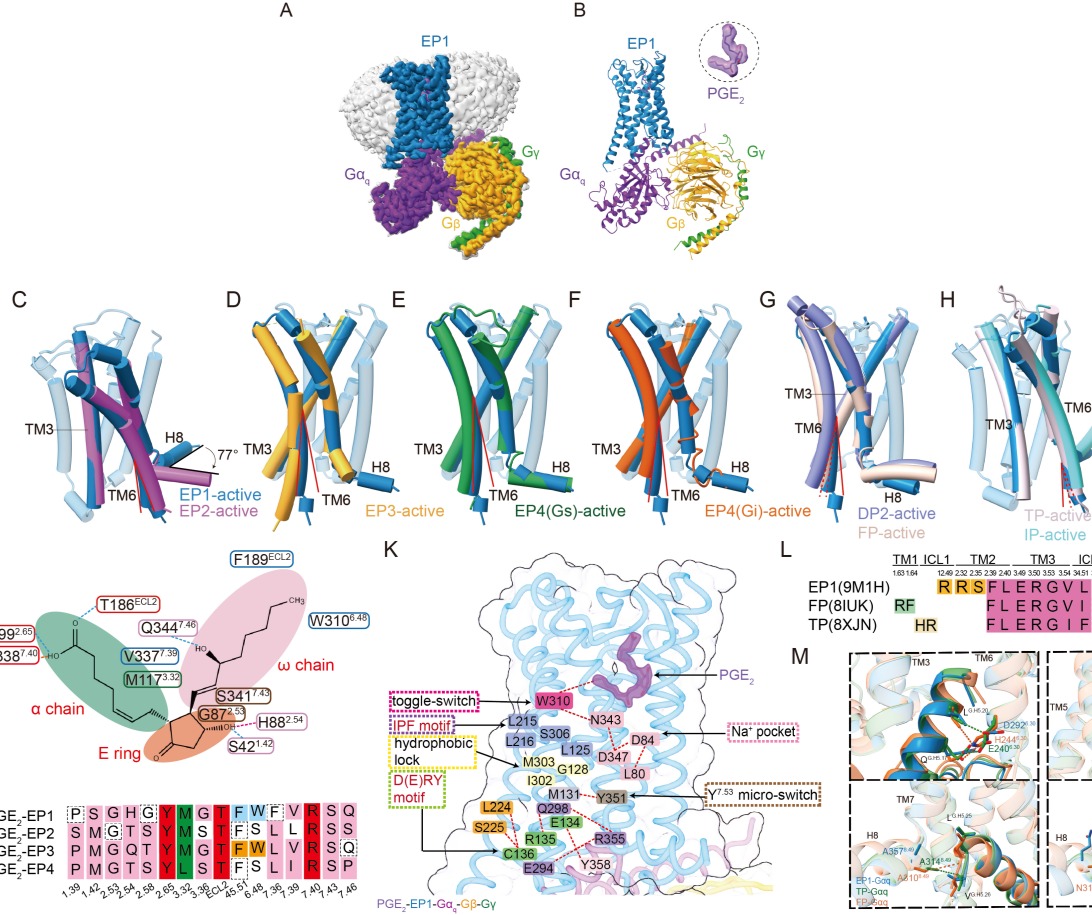
为解决这一难题,研究团队以冷冻电镜技术获得了分辨率为2.55 Å的人源PGE2-EP1-Gq复合物三维结构,系统解析了PGE2如何被EP1识别并激活下游信号通路。研究发现,EP1在激活过程中第六跨膜螺旋(TM6)的位移幅度明显小于其他亚型受体,提示其具有独特的构象变化与激活模式。
比较分析表明,EP1在与Gq蛋白偶联时展现出前列腺素家族中既保守又特异的模式。研究鉴定出11个在Gq偶联中高度保守的关键残基,同时也发现EP1独特的未参与Gq相互作用的残基,凸显不同受体之间偶联机制的差异性。
值得一提的是,徐华强课题组在前列腺素受体领域开展了系统性研究,先后解析了多个前列腺素受体的三维结构,包括FP2α受体(Nature Communications,2023)、TP受体(Science Advances,2024)和DP2受体(PNAS,2024)。该研究不仅首次揭示了EP1受体激活及Gq蛋白偶联的分子机制,填补了前列腺素受体家族结构信息的空白,也为开发靶向EP1受体的高选择性药物奠定了重要的结构基础。
上海市高峰电镜中心负责了该项研究冷冻电镜数据的收集。上海药物所硕士研究生孟雪为本论文第一作者。上海药物所徐华强研究员和徐有伟为本论文共同通讯作者。上海药物所为本研究的第一完成单位。该工作获得了国家自然科学基金委、科技部、中国科学院先导专项以及上海市市级科技重大专项等项目的资助。
全文链接:https://www.pnas.org/doi/10.1073/pnas.2423840122
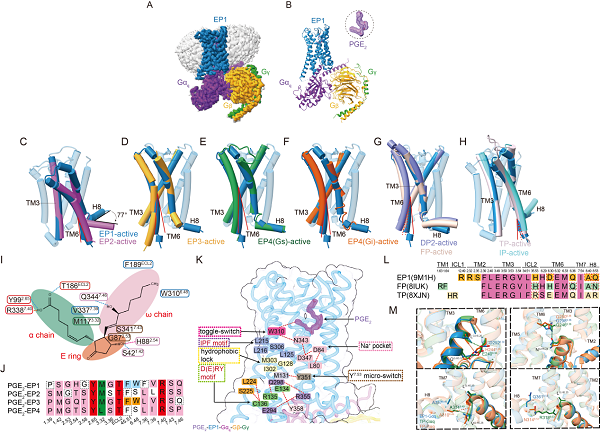
图片说明: PGE2结合并激活EP1受体的独特机制。 孟雪供图
(供稿部门:徐华强课题组)