PNAS|破解生殖密码:GnRHR结构解析为靶向治疗开辟新路径
1977年,诺贝尔生理学或医学奖授予Roger Guillemin和Andrew Schally,以表彰他们发现并合成“生殖密码”——促性腺激素释放激素(GnRH)。这一里程碑式的成果揭开了生命繁衍的分子奥秘,也为现代生殖医学和畜牧业带来了革命性变革。近半个世纪后,GnRH的受体(GnRHR)依然是科学家攻坚的焦点:它是不孕症、前列腺癌等生殖系统疾病的治疗靶点,甚至还是畜牧业中高效繁殖的“秘密武器”。大众所熟知的亮丙瑞林、戈舍瑞林就是靶向GnRHR的多肽类似物,它们在治疗前列腺癌及乳腺癌领域拥有着极高的市场份额。低表达和极不稳定的GnRHR精密地调控着人体的生殖平衡,然而,这也对蛋白表达、纯化以及结构解析提出了难题。GnRHR如何精确识别激素信号并激活下游通路的机制尚不清楚。
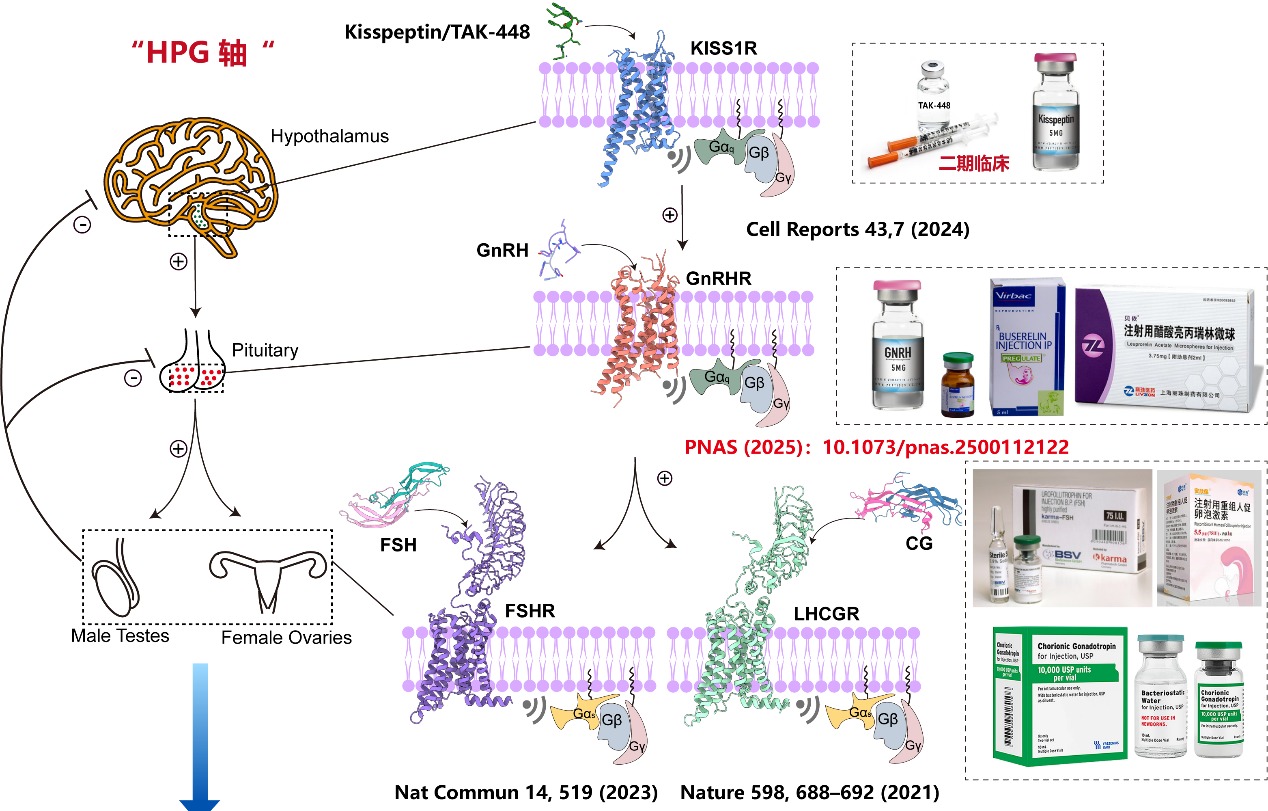
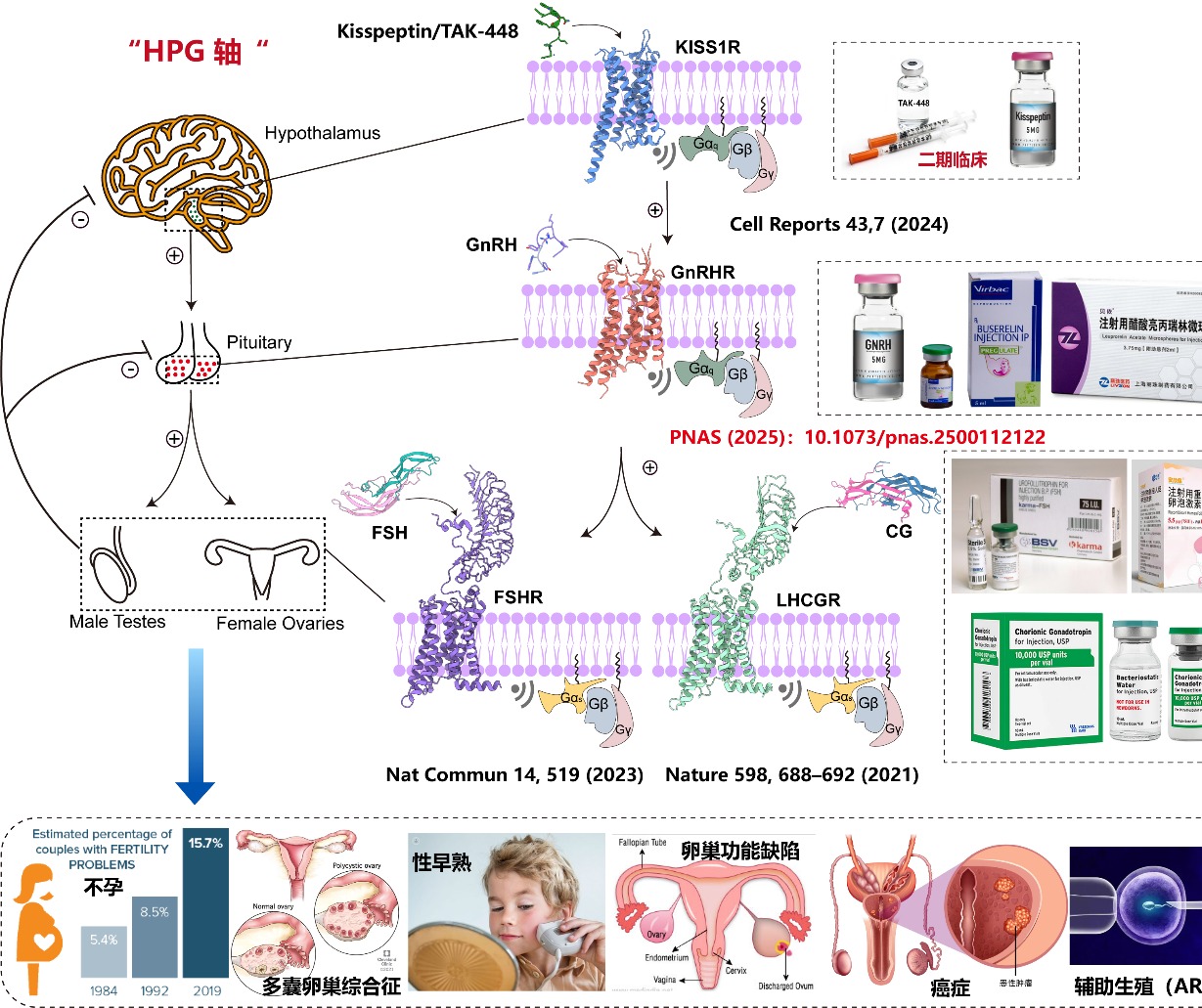
GnRHR是下丘脑-垂体-性腺轴(HPG)的核心受体,通过调控促性腺激素(LH和FSH)的分泌控制生殖功能。GnRHR的异常激活或抑制与不孕症、性早熟、子宫内膜异位症和前列腺癌等疾病密切相关。尽管GnRH类似物如亮丙瑞林、戈舍瑞林已广泛应用于临床,但其快速降解和脱靶效应限制了疗效。GnRH如何激活 GnRHR的结构信息长期缺失,阻碍了靶向药物的理性设计(图1)。
2025年6月17日,中国科学院上海药物研究所段佳研究员团队联合徐华强研究员团队,在《美国国家科学院院刊》(PNAS)在线发表了题为《Cryo-EM Structures of GnRHR: Foundations for Next-Generation Therapeutics》的研究论文。该研究首次通过高分辨率冷冻电镜技术解析了猪源(Sus scrofa)和非洲爪蟾源(Xenopus laevis)促性腺激素释放激素受体(GnRHR)与哺乳动物内源性GnRH及Gq蛋白的激动态复合物结构,并对近10种该靶点药物分子进行了深入构效关系分析,揭示了GnRH的保守识别机制和受体激活的分子基础,为开发新一代生殖疾病和癌症治疗药物提供了关键结构模板。
早在6年前,研究团队便开始尝试建立人源GnRHR的表达体系。然而,由于人源GnRHR结构上的独特性——缺乏大多数GPCR所具备的典型Helix 8结构,使得其在体外的高效表达与纯化面临极大挑战。直到2024年初,段佳研究员在参加第五届国际促性腺激素及其受体会议期间,受到美国国家科学院院士Wayne Hendrickson报告的启发,团队开始尝试从其他物种中筛选更易表达纯化的GnRHR作为研究对象。
GnRHR是一种进化高度保守的基因,广泛存在于几乎所有脊椎动物中并执行类似的生理功能。通过跨物种序列比对发现,非哺乳动物的GnRHR通常保留有典型的Helix 8结构,而哺乳动物中则普遍缺失该结构域。基于此差异,研究团队筛选了两种与人源GnRHR具有代表性差异的物种:一是与人源GnRHR序列同源性高达91.2%的猪源GnRHR(pGnRHR),另一种是与人源序列差异较大的非洲爪蟾GnRHR(fGnRHR,同源性为44.3%)。最终,团队成功解析了GnRH激活状态下,pGnRHR和fGnRHR分别与Gq蛋白结合形成的复合物冷冻电镜结构,其分辨率分别达到3.18 Å和2.67 Å(图1)。
结构研究显示,GnRH在两种复合物中均以独特且保守的“倒U形”构象嵌入受体正构口袋,其N端与C端分别插入受体口袋的不同区域,并与跨膜螺旋(TM3、TM5–TM7)及胞外环(ECL2/3)上的关键残基形成特异性相互作用。多物种序列比对结果进一步揭示,该结合口袋周围的关键残基具有高度保守性,其中如K3.32、Y6.51和Y6.52等残基通过氢键和π–π堆叠相互作用稳定GnRH的结合模式,突显了GnRH识别在物种进化中的保守特征。与此同时,也观察到特定物种如fGnRHR在ECL3构象上的差异,提示该区域可能参与了功能精细调控的进化适应。功能实验证实,结构中揭示的保守残基对GnRH诱导的信号传导具有显著影响(图2),进一步验证了结构–功能之间的内在联系。
基于激动态结构,研究团队进一步构建并分析了9种已上市GnRH类似物(如曲普瑞林、那法瑞林等)的受体结合构象,系统总结其构效关系(SAR)。他们发现多肽中第6位甘氨酸被D型氨基酸(如D-Trp)取代,可显著增强其“预折叠”能力,稳定其激动构象(type II’ β-turn),进而提高药物活性并增强突变耐受性。该发现不仅揭示了GnRH类似物激活受体的分子机制,也为新一代GnRHR靶向药物优化提供了明确方向。
GnRHR作为调控人类生育与性发育的“中枢开关”,是连接基础研究与临床转化的桥梁。本研究不仅填补了GnRHR激活机制的结构空白,更为新一代小分子与多肽药物的结构优化与创新开发提供了坚实基础。未来,依托该结构信息与构效规律,有望开发出更安全、更稳定、作用更精准的GnRH类药物,造福广大不孕症与激素相关肿瘤患者。
中国科学院上海药物研究所博士生沈诗怡为本文的第一作者。中国科学院上海药物研究所段佳研究员、徐华强研究员为共同通讯作者。上海市高峰电镜中心负责了该项研究冷冻电镜数据的收集。该工作得到中国科学院战略性先导科技专项、上海市市级科技重大专项、国家自然科学基金、国家重点研发计划、中国科学院上海分院青年攀登计划、上海市扬帆计划等项目资助。
值得一提的是,本研究是段佳、徐华强团队近年来继解析LHCGR(Nature, 2021)、FSHR(Nat Commun, 2023)及KISS1R(Cell Reports, 2024)结构之后,在性腺轴(HPG轴)GPCR结构研究与药物开发领域的又一关键成果。研究团队系统勾勒出从上游(KISS1R)到中枢(GnRHR)再到下游(FSHR/LHCGR)的结构调控图谱,正在构建完整的结构药理学框架,推动生殖类疾病的精准治疗(图1)。段佳研究员自2023年独立建组以来,课题组致力于从结构到功能、从机制到转化的全链条GPCR研究,持续拓展该领域的研究深度与广度。当前,团队因科研发展需要,诚挚欢迎具有免疫、代谢、生物信息等学科背景的优秀博士及博士后加盟,共同推动GPCR领域的原创性突破与转化应用发展。
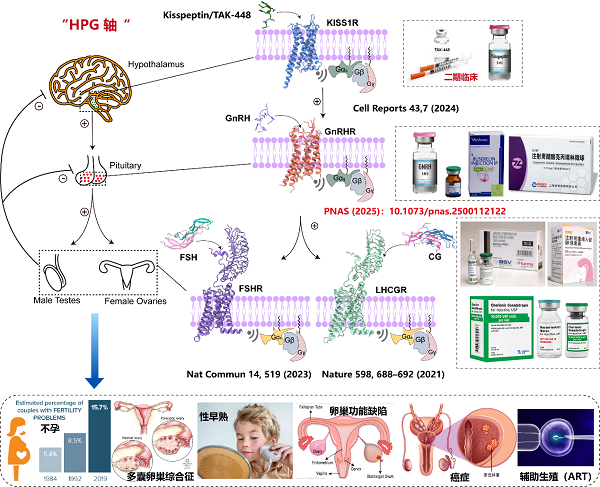
图1. 位于下丘脑-垂体-性腺轴(HPG)的关键GPCR信号、蛋白结构以及临床药物
与适应症
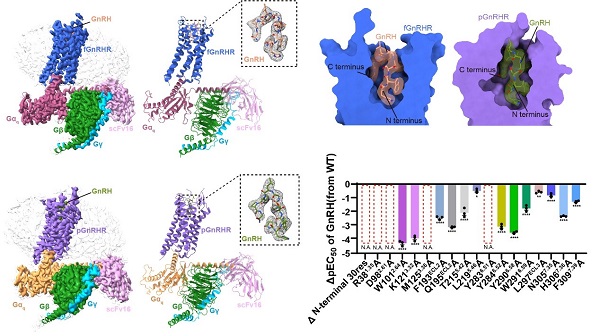
图2. GnRH与非洲爪蟾源以及猪源GnRHR-Gq复合物的冷冻电镜结构
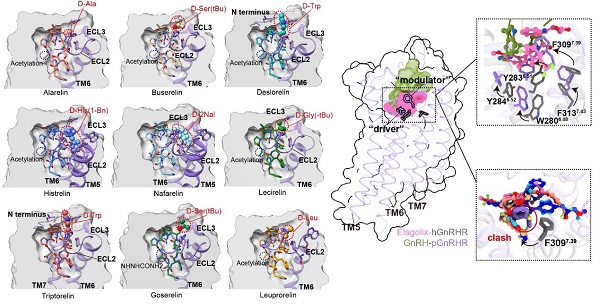
图3. GnRHR药物建模与构效关系示意图
(供稿部门:段佳课题组)