Sci. Transl. Med | 上海药物所利用人工智能技术发现甲氨蝶呤抗肿瘤免疫的新用途和新机制
2025年6月4日,中国科学院上海药物研究所郑明月/张素林团队联合盐城市第一人民医院耿炜团队,于Science Translational Medicine杂志在线发表了题为“Methotrexate exerts antitumor immune activity and improves the clinical efficacy of immunotherapy in patients with solid tumors”的研究论文。该研究揭示,经典免疫抑制药物甲氨蝶呤可以通过选择性诱导肿瘤细胞中cGAMP生成,同时抑制ENPP1介导的cGAMP水解,来发挥抗肿瘤免疫作用。低剂量甲氨蝶呤治疗不仅在小鼠模型中显著增强了免疫疗法与放射疗法的抗肿瘤效果,在初步临床试验中也观察到了类似的增效作用。本研究揭示了甲氨蝶呤此前未被报道的免疫激活功能,并为在临床实践中将其与肿瘤免疫治疗及放疗联合应用提供了理论基础。
近年来,肿瘤免疫治疗取得了重大进展,但原发性与获得性耐药问题仍然存在。cGAS-STING通路激活可以诱导肿瘤微环境中免疫细胞浸润和抗原呈递,增强免疫疗法的敏感性。然而,由于STING蛋白在全身组织中广泛表达,直接使用STING激动剂可能导致全身性免疫毒性。ENPP1通过水解cGAMP负向调控STING信号,且在多种肿瘤组织中高表达,因此选择性抑制ENPP1有望实现肿瘤微环境特异性STING信号激活,避免全身性免疫毒性反应。
甲氨蝶呤最初作为二氢叶酸还原酶抑制剂被发现,通过抑制核酸合成来发挥抑制肿瘤生长作用。目前,甲氨蝶呤还被用作免疫抑制剂,是治疗类风湿性关节炎的临床一线用药。在前期工作中,蒋华良/郑明月团队开发了一种利用微扰转录组数据预测药物-靶标相互作用的孪生谱图卷积网络(SSGCN)算法,并利用该算法预测甲氨蝶呤具有ENPP1抑制作用(Protein Cell 2022, 13, 281-301)。
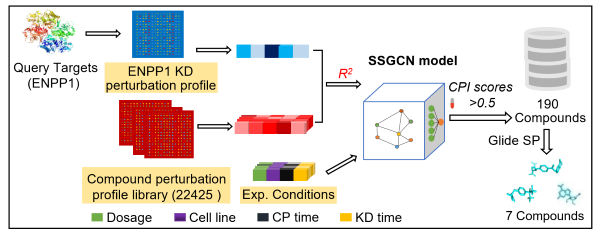
图1. 使用SSGCN模型从基因转录图谱中发现甲氨蝶呤为ENPP1的抑制剂
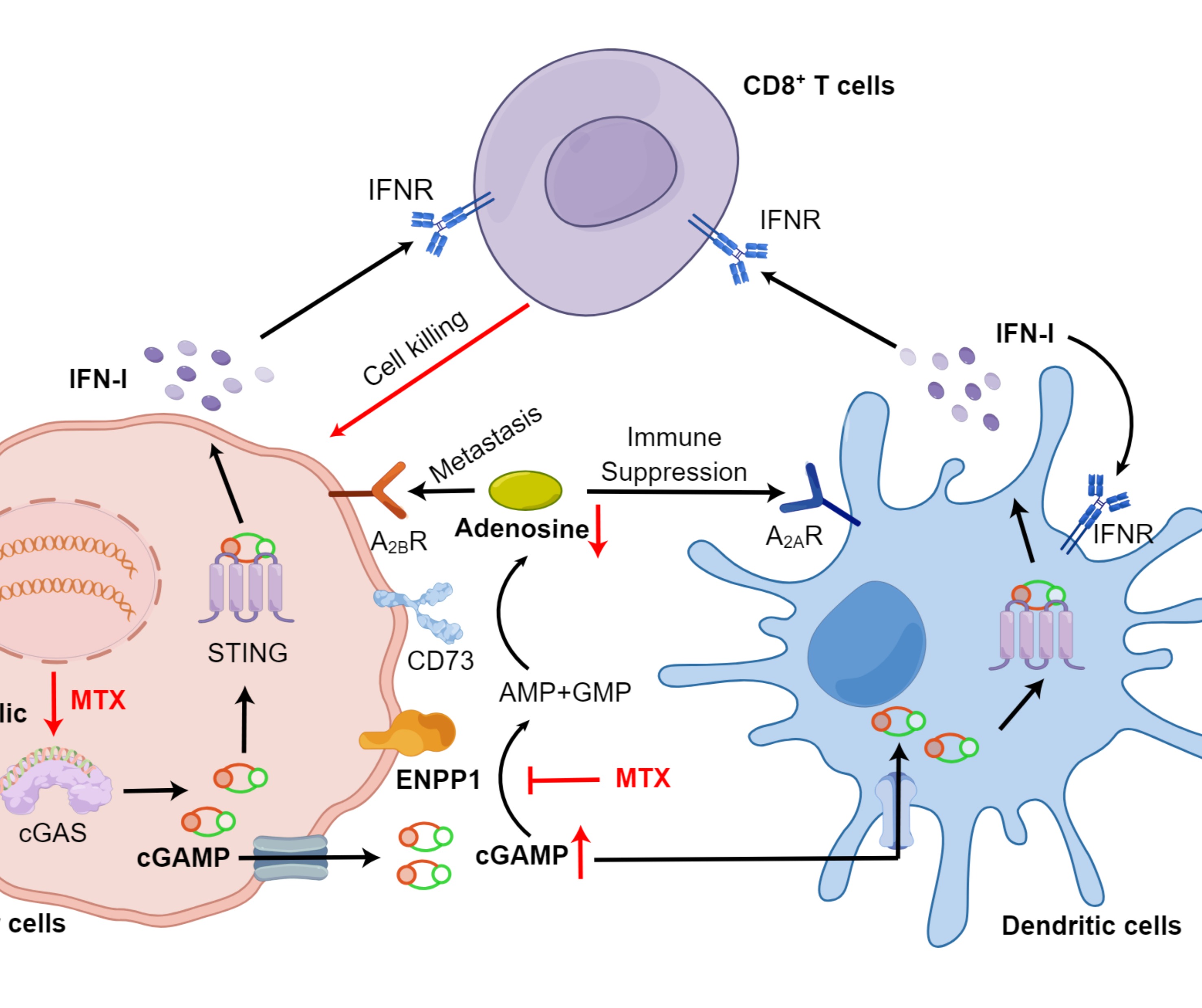
在本研究中,研究团队揭示了甲氨蝶呤在肿瘤微环境中此前未被认识到的免疫激活作用。甲氨蝶呤可以选择性诱导肿瘤细胞DNA损伤、cGAS-STING通路激活以及cGAMP生成,同时还能够抑制ENPP1介导的胞外cGAMP水解和腺苷生成,从而显著增强树突状细胞浸润并促进CD8+T细胞活化。因此,甲氨蝶呤治疗增强了放射治疗的疗效,并克服了肿瘤对免疫检查点阻断治疗的耐药性。这一发现不仅为甲氨蝶呤联合放疗或免疫治疗提供了理论依据,更开拓了靶向ENPP1/DNA损伤双重通路的新型抗肿瘤药物研发思路,具有重要的临床转化价值。
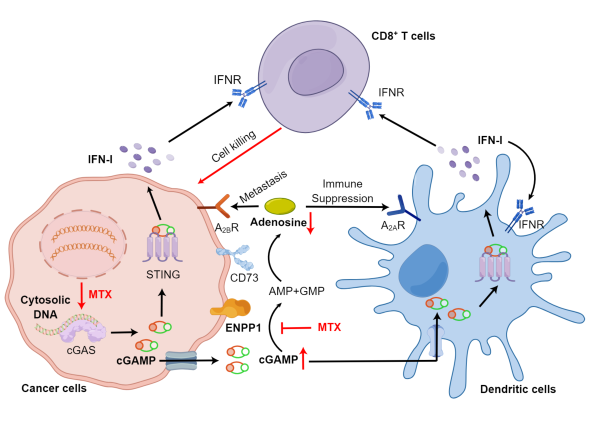
图2. 甲氨蝶呤发挥抗肿瘤免疫作用的机制示意图
国科大杭州高等研究院副研究员杨瑞瑞、上海药物所和南京中医药大学联合培养研究生王蓓博士为本文的共同第一作者。上海药物所郑明月研究员、张素林副研究员、以及盐城市第一人民医院放疗科耿炜主任为论文通讯作者。本研究得到了国家自然科学基金、国家重点研发计划、中国科学院战略性先导科技专项、中国科学院青年创新促进会会员项目、上海市自然科学基金、上海药物所与上海中医药大学中医药创新团队联合研究项目、中国科协青年人才托举工程项目以及江苏省卫健委科技项目的资助。
原文链接:https://www.science.org/doi/10.1126/scitranslmed.adn6921
(供稿部门:郑明月课题组)