多巴胺(dopamine, DA)是人体中枢神经系统和周围神经系统的主要神经递质之一,通过结合多巴胺受体发挥众多重要的生理功能,包括学习、记忆、认知、奖励、情感、调节情绪和控制运动等1。多巴胺受体属于G蛋白偶联受体(G protein-coupled receptor, GPCR)超家族,包含D1R到D5R共五个受体成员,其中D1R和D5R两个亚型偶联激活型G蛋白(Gs),而D2R、D3R和D4R通过激活抑制型G蛋白(Gi)发挥其生物学功能。多巴胺信号转导的失衡和改变是导致多种精神类疾病的原因之一,这些疾病包括帕金森症(parkinson's disease)、精神分裂症、阿尔兹海默症和亨廷顿氏病等。作为多巴胺受体中重要的成员,D3R是当前帕金森病、药物成瘾和精神分裂等疾病的热门靶点之一。临床用于帕金森病治疗的药物多为D2R和D3R的激动剂,如临床获批用于帕金森病和不安腿综合征(Willis-Ekbom病)治疗的普拉克索(pramipexole)等2,3。普拉克索和小分子激动剂PD128907均能激活D2R和D3R,尤其对D3R亚型表现出优于D2R和D4R的选择性。多年以来,以抗帕金森疾病药物为代表的大部分多巴胺受体激动剂都是以分布更为广泛的D1R和D2R为药物靶点。但是,越来越多的研究表明:D3R更集中地分布在大脑中某些对精神疾病极为关键的部位,例如腹侧纹状体,包括伏隔核,丘脑,海马体和皮质。实际上,内源性配体多巴胺和大部分用于临床治疗的多巴胺受体激动剂药物,都表现出对D3R亚型更高的亲和力。这些都表明D3R受体在精神疾病的发生发展和药物开发中的重要地位和价值。通过对D3R受体进行结构药理学研究揭示配体选择性的分子机制对理解D3R激活和设计高效低毒的多巴胺受体靶向药物具有重要的理论意义和应用价值。目前尽管已有若干多巴胺受体亚型的高分辨率结构获得解析,包括D2R,D3R和D4R与拮抗剂结合复合物的晶体结构和D2R与激动剂复合物的冷冻电镜结构等。然而,D3R与激动剂结合复合物的结构仍未获得解析,极大地限制了人们对D3R配体识别和受体激活机制的理解,成为了制约基于结构的靶向D3R受体药物研发的瓶颈。
2021年2月5日,中国科学院上海药物研究所徐华强研究员和程曦副研究员、浙江大学医学院与浙江省良渚实验室张岩研究员、以及北卡罗来纳大学教堂山分校Bryan L. Roth教授等共同在Molecular Cell杂志上在线发表了他们最新的研究成果“Structures of the human dopamine D3 receptor-Gi complexes”,首次解析了D3R分别与帕金森病治疗药物普拉克索和小分子激动剂PD128907,以及抑制型Gi蛋白复合物的高分辨率冷冻电镜结构,揭示了配体选择性识别和激活D3R的分子机制。
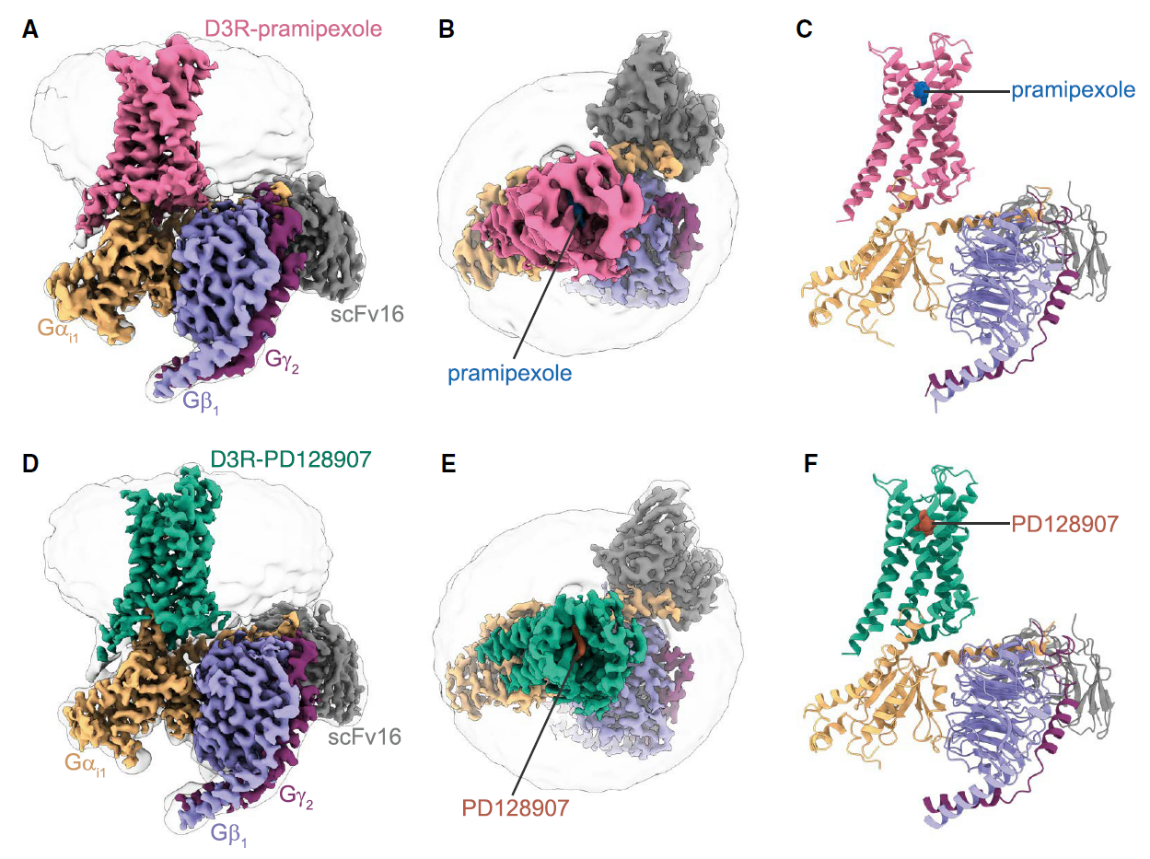
研究团队采用单颗粒冷冻电镜分别对帕金森病治疗药物普拉克索和小分子激动剂PD128907激活D3R后形成的复合物分别进行了结构重塑,最终解析了D3R在两种配体激活情况下与Gi蛋白的复合物结构。其中,普拉克索与D3R-Gi复合物结构的分辨率为3.0埃;PD128907与D3R-Gi复合物结构的分辨率达到了2.7埃,代表了当前A型GPCR冷冻电镜结构研究的最高解析度(图1)。
图1. D3R-Gi复合物的冷冻电镜结构
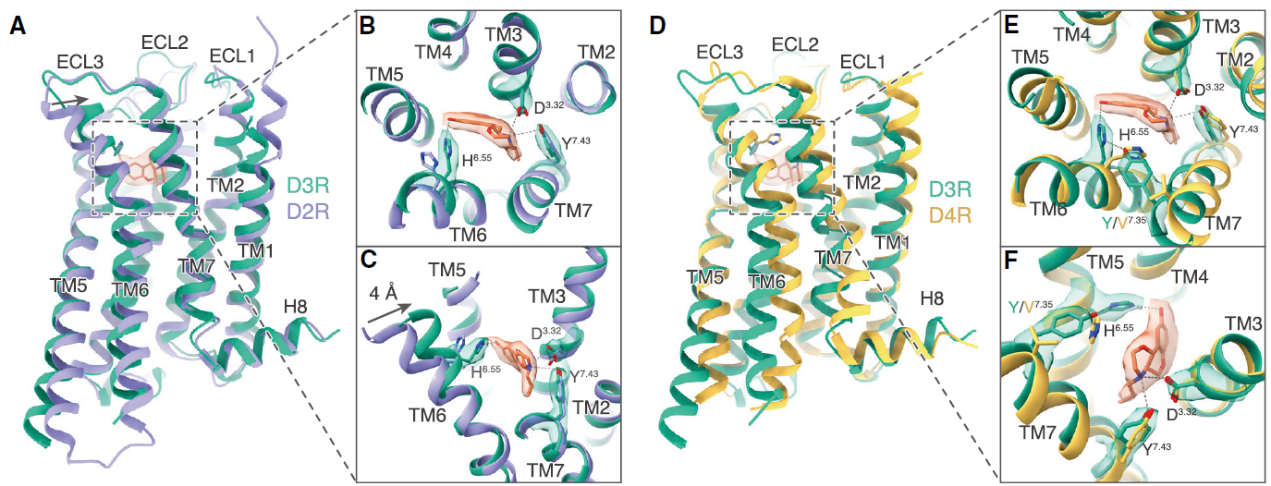
通过比对D3R受体分别与普拉克索和PD128907两种激动剂结合的结构细节,研究团队发现了两种小分子激动剂与受体结合具有明显的特征区别;通过与D2R和D4R激活结构的比对分析发现,结合口袋中TM6上的6.55位组氨酸的空间位置是决定配体对多巴胺受体亚型D2R、D3R和D4R选择性的决定性因素;研究同时对多巴胺受体各亚型偶联下游Gs和Gi选择性的机制进行了探讨,发现受体TM6上的三个特定位置的差异残基(6.31, 6.36和6.38位)是导致不同多巴胺受体亚型选择性偶联Gs或Gi的决定因素,这与徐华强研究员团队在2018年报道的Rhodopsin-Gi结构所揭示的Gs/Gi选择性机制相符合4;研究进一步发现,D3R与其他Gi偶联GPCR类似,均通过高度相似的静电相互作用类型偶联下游Gi蛋白;此外,研究揭示了多巴胺受体偶联Gi和Go这两类高度保守的G蛋白类型选择偏向性的分子基础。D3R具有Go蛋白的选择偏向性,而D2R对Gi蛋白具有更高的选择性。通过对D2R和D3R的结构观察发现,D3R的TM6相对D2R更具刚性,摆动幅度更小,导致产生了更小尺寸的跨膜螺旋胞内口袋,而Go蛋白相对Gi具有相对更小的氨基酸侧链,因此D3R较D2R表现出更为显著的Go蛋白偶联偏向性(图2)。
图2 配体对D2R、D3R和D4R亚型选择性的分子机制
综上所述,团队利用单颗粒冷冻电镜技术首次解析了选择性D3R激动剂、D3R受体与效应G蛋白的复合物结构,从而在原子分辨率上详细阐释了D3R受体选择性识别配体,被激活后与G蛋白偶联的分子机制。该成果阐述了多巴胺受体D3R配体识别选择性和激活机制等重要的生物学问题,也为开发以多巴胺受体为靶标的选择性药物提供了重要的结构模型。
冷冻电镜数据在浙江大学冷冻电镜中心收集。研究工作同时得到了中国科学院上海药物研究所蒋华良院士和余学奎研究员,以及美国温安洛研究所的Karsten Melcher教授的帮助。上海药物研究所与浙江大学基础医学院联合培养博士生徐沛雨、上海药物研究所与上海科技大学联合培养博士生黄思婕、浙江大学基础医学院博士后毛春友和北卡罗来纳大学教堂山分校的Brian E. Krumm为本文共同第一作者。浙江大学为第一完成单位。该工作获得了上海市市级科技重大专项、科技部重点研发计划、中科院先导项目、国家自然基金委、浙江省自然基金委等的资助。
文章链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(21)00003-4
参考文献:
1、Kiss, B. et al. Neuronal Dopamine D3 Receptors: Translational Implications for Preclinical Research and CNS Disorders. Biomolecules 11, doi:10.3390/biom11010104 (2021).
2、Hubble, J. P. et al. Pramipexole in patients with early Parkinson's disease. Clin Neuropharmacol 18, 338-347, doi:10.1097/00002826-199508000-00006 (1995).
3、Morgan, J. C. & Sethi, K. D. Efficacy and safety of pramipexole in restless legs syndrome. Curr Neurol Neurosci Rep 7, 273-274 (2007).
4、Kang, Y. et al. Cryo-EM structure of human rhodopsin bound to an inhibitory G protein. Nature, doi:10.1038/s41586-018-0215-y (2018).
(供稿部门:徐华强课题组;供稿人员:徐沛雨)